
一、 实验原理
免疫组化(IHC),是应用抗原与抗体特异性结合的原理,通过酶标抗体与底物反应显色,从而对组织细胞内抗原进行定位、定性及定量的研究,称为免疫组织化学技术。
抗体和抗原之间的结合具有高度的特异性,免疫组织化学正是利用了这一原理。先将组织或细胞中的某种化学物质提取出来,以此作为抗原或半抗原,通过免疫动物后获得特异性的抗体,再以此抗体去探测组织或细胞中的同类的抗原物质。由于抗原与抗体的复合物是无色的,因此还必须借助于组织化学的方法将抗原抗体结合的部位显示出来,以其达到对组织或细胞中的未知抗原进行定性,定位或定量的研究。
免疫组织化学技术按照标记物的种类可分为免疫荧光法,免疫酶法,免疫铁蛋白法,免疫金法及发射免疫自影法等。
二、 应用简介
免疫组化(IHC)具有特异性强、敏感度高、定位准确的优点。
1. 只要是形态科学均可采用:包括病例学、神经内科学、生物学、病院微生物的检测(病毒、细菌、寄生虫等)、皮肤病学、器官移植等。
2. 可用于多种材料:各种组织(冰冻组织、formalin固定组织、石蜡包埋组织兼可);各种细胞(穿刺、体液、图片、血细胞、培养细胞等)。
3. 用于诊断:肿瘤病理学等。
4. 用于科研:临床和基础医学,尤其是形态学专业;在分子生物学研究中,用免疫组织化学方法对多研究的大分子进行定位,进而深入研究其功能。
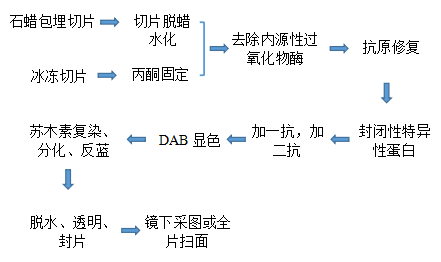
三、实验方法
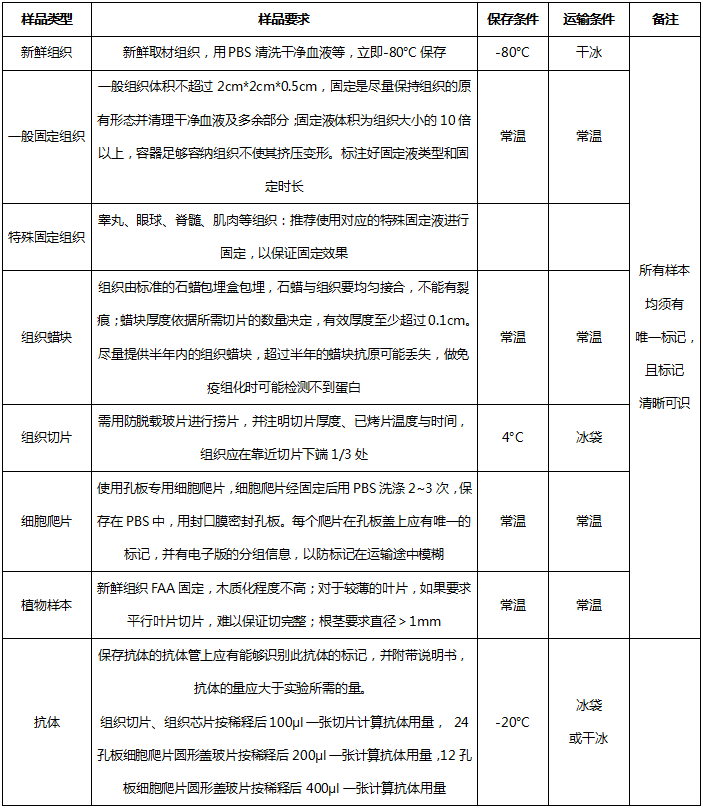
四、样本送检要求
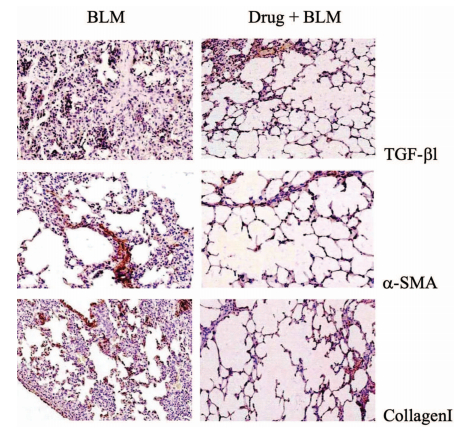
五、 案例展示
六、 常见问题
(1)对照/标本无染色
① 确认是否忽略了应该加的某种试剂,包括一抗、二抗、三抗及底物等。
② 确认所有的试剂是否按正确的顺序加入,是否孵育了足够的时间。
③ 对照抗体的标签确认是否使用了正确的抗体,以及所用的检测系统是否和一抗匹配,这一点是非常重要的。比如,如果一抗是兔来源的抗体,二抗一定要用抗兔的二抗来匹配;或一抗是小鼠的IgM一抗,二抗必须是山羊/兔抗小鼠的IgM(不是IgG)二抗。
④ 检查抗体所使用的稀释度及稀释溶液。
⑤ 检查抗体的有效期和保存条件,尤其是标记了酶或荧光素的抗体,现在大多数试剂公司的抗体均要求在4~8℃条件下保存,应避免反复冻融,试剂保存时一定要避免与挥发性有机溶剂同放一室,以免降低抗体的效价。
⑥ 检查标本的储存条件,最好用已知阳性的标本来同时做阳性对照。
⑦ 检查色原/底物溶液,最简单的检测方法是将一滴标记有酶的抗体加入到制备好的底物溶液中,如果底物发生预期的颜色变化,则可排除底物的因素。需要注意的是,有些底物在制成工作液后应在一定时间内用完,否则会失效。
⑧ 检查冲洗液是否和反应试剂匹配,溶液的pH值很重要,与过氧化物酶底物匹配的溶液中不应含有叠氮钠。
⑨ 检查复染剂和封片剂是否和所使用的色原匹配。
(2)弱阳性
如果阴性对照没有染色而阳性对照标本弱阳性,除了考虑上述因素外,还应考虑:
① 标本的固定方式,不当的固定方式或固定时温度过高,都会影响到所检测的抗原的数量和质量。
② 不适当的抗原修复方式,由于石蜡切片在制作的过程中固定剂对抗原的封闭作用,必须用抗原热修复或酶消化或两种同时使用的抗原双暴露法,至于使用哪一种方法,应参照生产厂家的说明,同时结合标本的具体情况而定。
③ 抗体的稀释度是否过高或者孵育的温度/时间是否正确。一般试剂生产厂家都会对试剂给出一定的使用范围,但是由于使用者的标本来自各种组织,处理过程也不尽相同,所以应参照使用范围,对所使用的一抗进行梯度测试,找出最佳的使用浓度。
④ 切片上遗留了过多的冲洗液,当抗体加至切片上时,等于人为地对抗体进行了进一步的稀释。
⑤ 孵育时切片是否放置水平,否则会导致抗体流失。
如果阴性对照没有反应,阳性对照反应良好,而标本弱阳性,则可能是由于阳性对照不是同一种组织、或固定方式不同等原因所致。
(3)非特异性染色
① 是否有效地去除了内源性酶和生物素。应注意的是,并不是每一种组织均需要进行此步骤,但对于内源性酶或生物素丰富的组织,如肝脏、肾脏等,需考虑此原因。处理的方法为:灭活碱性磷酸酶:最常用的方法是将左旋咪唑(24mg/m1)加入底物液中,并保持pH值在7.6~8.2,即能除去大部分内源性碱性磷酸酶,对于仍能干扰染色的酸性磷酸酶,可用50mmol/L的酒石酸抑制。
饱和处理内源性生物素:消除内源性生物素的方法是事先滴加亲和素,以饱和内源性生物素,使之不再有剩余的结合位点。具体方法是在ABC法或SP法染色前将切片浸于25ug/ml亲和素溶液中处理15分钟,PBS清洗15分钟后即可染色。
② 是否选择使用了正确的封闭血清。电荷吸附所造成的非特异性背景染色消除方法是以二抗动物的非免疫血清,用PBS稀释为3%-10%溶液孵育切片,以封闭吸附位点。有时其它无关蛋白,如牛血清白蛋白也常应用。另外,取材时避开出血、坏死区亦极重要。最近有些国内的实验室应用5%脱脂奶粉替代血清进行抗原封闭,效果也不错。
③ 所选择的抗体是否符合试验要求。因抗原不纯、标本片中含有与靶抗原相似的抗原决定簇等原因造成的非特异性染色只能通过采用高纯度、高效价的抗体、或针对更具特异性抗原决定簇的单克隆抗体来解决。
④ 一抗的使用浓度是否过高。
⑤ 清洗是否充分。应严格操作规程。因在缓冲液中含有一定量的盐,这亦有利于减低背景着色,通常0.05mol/l Tris-HCl,0.15mol/l NaCl已适用于多数染色方法,溶液内加入吐温20,效果更佳。特殊标记时,试剂公司一般都提供缓冲液的配方。
⑥ DBA的使用是否正确。DAB的孵育时间和配制方式可以产生某些背景颜色,使用浓缩型DAB试剂盒时,请严格按照说明书标明的滴加顺序操作,注意校正蒸馏水的pH值,以确保实验结果的正确性;粉剂DAB溶解时,常有一些不溶性颗粒,这些颗粒须经过滤除去,否则可能沉积于切片组织上,产生斑点状着色。另外,DAB保存不妥产生氧化物亦可沉积于切片上,因此需将DAB保存于避光干燥处,现用现配,临用前加H2O2.孵育时间过长也会造成背景染色。
⑦ 标本染色过程中是否曾经干涸,否则会造成边缘部的非特异性染色。
⑧ 检查二抗与标本的内源性组织蛋白是否有交叉反应。
七、服务流程

病理学检测
分子生物学检测
免疫学检测服务
细胞实验服务
动物实验平台