
一、 实验原理
慢病毒表达载体包含了包装、转染、稳定整合所需要的遗传信息。慢病毒包装质粒可提供所有的转录、包装、重组的假病毒载体所需要的所有辅助蛋白。为产生高滴度的病毒颗粒,需要利用表达载体和包装质粒同时共转染细胞,在细胞中进行病毒的包装。包装好的假病毒颗粒分泌到细胞外的培养基中。离心收集上清液后,可以直接用于宿主细胞的感染,目的基因进入到宿主细胞之后,经过反转录,整合到基因组,从而高水平的表达效应分子。

二、应用简介
慢病毒(Lentivirus)载体是以HIV-1病毒为基础发展起来的基因研究载体,区别于逆转录病毒载体,它对于分裂细胞和非分裂细胞均具有感染能力。
实验平台的慢病毒系统属于第三代慢病毒系统,生物安全性高,采用VSVG包膜,宿主范围广泛,慢病毒滴度高,其病毒滴度可以达到10^9TU/mL。
目前的慢病毒载体有CMV、mCMV、CAG、PGK、UbC、EF1a、GFAP、NSE等多种启动子可供选择;而且还有EGFP、ZsGreen、tdTomato、mCherry、EYFP等多种荧光标记蛋白可供选择;抗生素筛选基因有Puromycin、Neomycin、Hygromycin等可供选择。
在细胞实验中,对于按常规方法难以转染甚至无法转染的细胞,通过使用病毒介导的方式能够大大提高基因的转导效率,达到目的基因高效表达的目的。
具体来说,慢病毒包装主要应用于以下几个方面:
1、对于难转染的细胞,如原代细胞、干细胞、不分化的细胞等,能大大提高目的基因转导效率,而且目的基因整合到宿主细胞基因组的几率大大增加,极大地方便了RNAi,cDNA克隆以及报告基因的研究;
2、进行稳转细胞株的筛选;
3、为活体动物模型实验提供高质量的包含目的基因的病毒液。
三、 实验方法
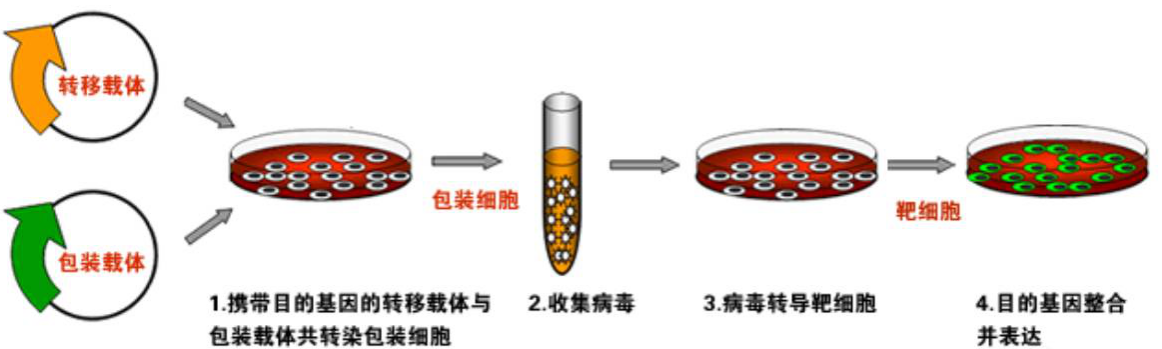
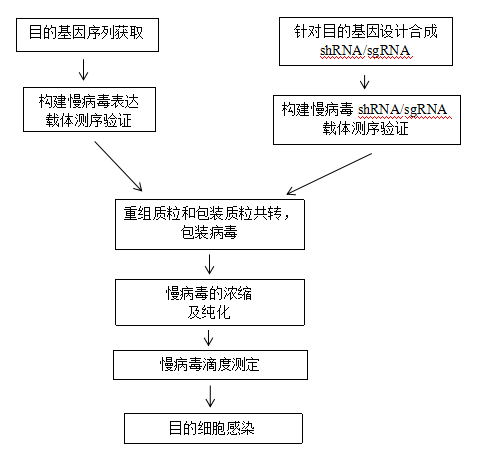
四、样本送检要求
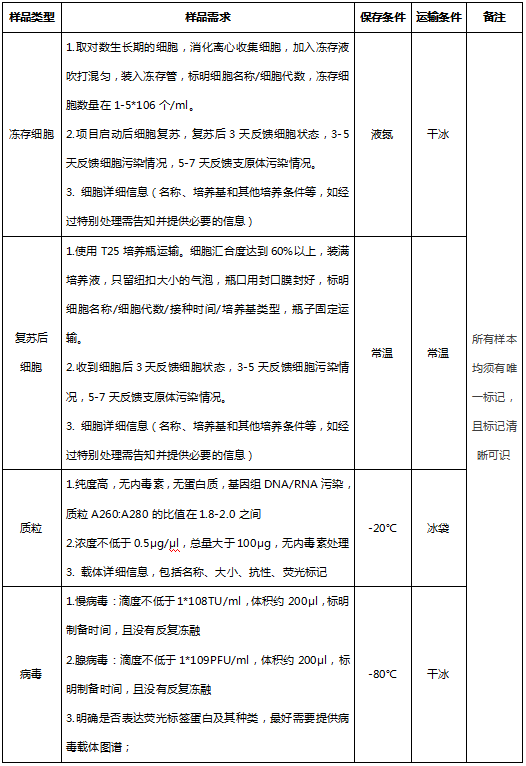
五、案例展示

六、常见问题
1.慢病毒理论上可以包装5~7Kbp的片段,但过大的片段包装会影响病毒的出毒效率,导致获得的病毒滴度较低,影响病毒感染效果。因此一般建议最好将包装的片段控制在1.5Kbp以内。
2.病毒载体易突变和丢失,克隆过程中可能出现质粒的包装信号突变或大小不等的片段丢失,导致无法成功包装出病毒。因此建议构建好含有目的基因的克隆载体(尤其插入片段大于1.5Kbp)后首先进行测序,以确保关键序列都正确无误。
3.包装细胞多选择为293T或293FT。要求细胞生长旺盛、状态良好,避免过密生长和体外传代次数过多。
4.转染时对质粒纯度要求较高,最好为去掉内毒素的超螺旋质粒,以提高转染效率。多采用磷酸钙转染方法,既节约成本又可获得高的转染效率(一般可达到80%~95%)。
5.无论是三质粒或四质粒慢病毒系统,转染的各质粒之间的比例非常重要,直接影响出毒效率。不同公司提供的质粒有所差别,因此无法一概而论,需要根据给出的比例进行调整优化。
6.转染前,细胞密度控制在50%~60%为佳。转染前4~8h换液,转染后不换液。转染第2天添加丁酸钠(TPA)可明显提高出毒率,之后8h再换液。每次换液前应将培养基预热至37℃,换液时动作轻柔以防细胞漂起。
7.一般情况下,转染48h后收获得到的病毒颗粒最多,但也与当时细胞状态、生长速度和培养基pH值有关。收获病毒时培养基应呈红色,若过酸呈现黄色则会降低病毒收获率。
8.不同厂家和批次的血清对病毒的产量影响很大,需要筛选。
9.病毒液避免反复冻融,否则明显降低效率。
10.一般情况下,病毒液于-80℃中可保存1年,但建议半年之后重新检测病毒滴度。
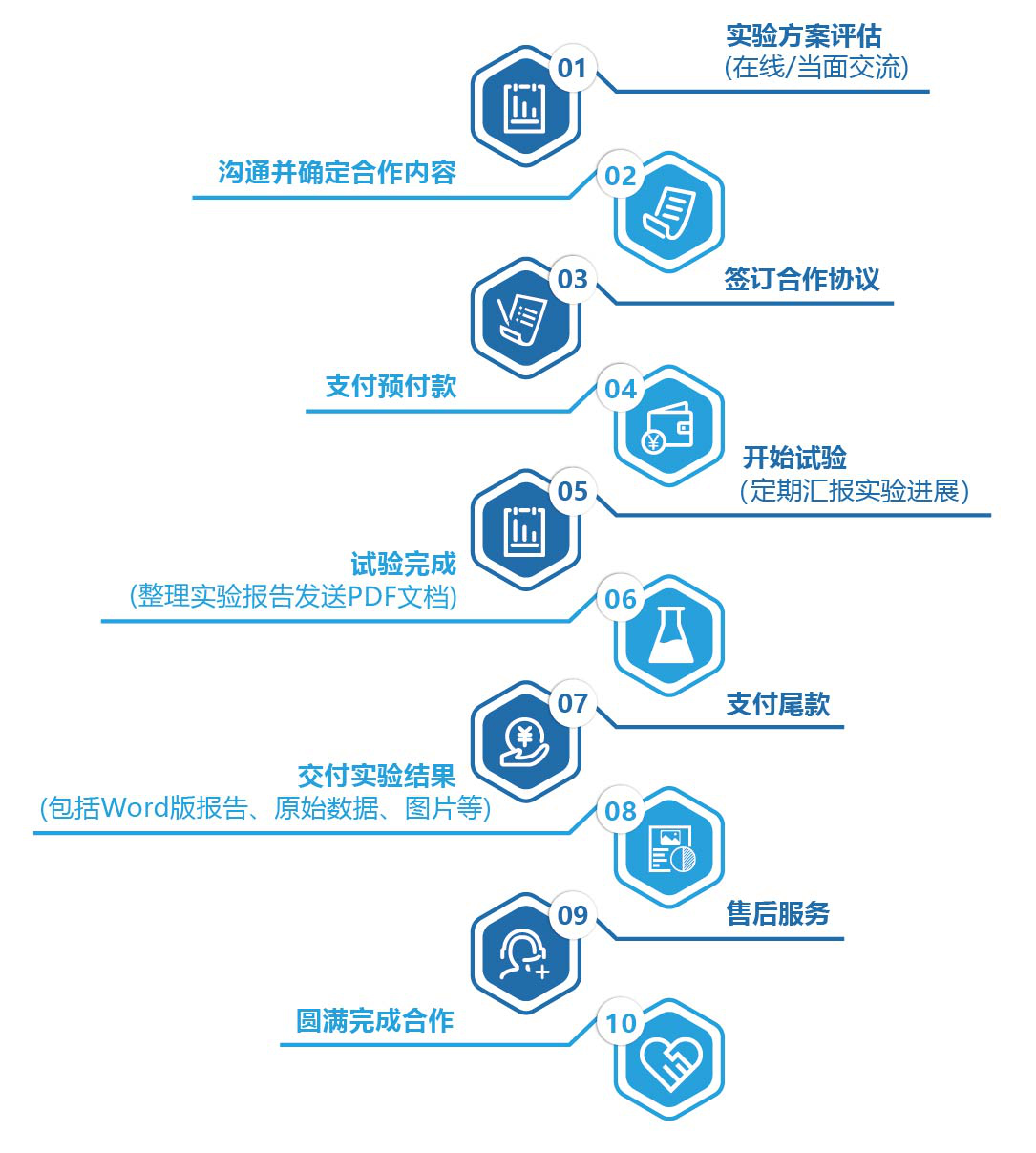
七、服务流程
病理学检测
分子生物学检测
免疫学检测服务
细胞实验服务
动物实验平台